Hukum Termodinamika I
ΔU = Q − W
Keterangan :
ΔU = perubahan energi dalam (joule)
Q = kalor (joule)
W = usaha (joule)
Proses-proses
Isobaris → tekanan tetap
Isotermis → suhu tetap → ΔU = 0
Isokhoris → volume tetap (atau isovolumis atau isometric) → W = 0
Adiabatis → tidak terjadi pertukaran kalor → Q = 0
Siklus → daur → ΔU = 0
Persamaan Keadaan Gas
Hukum Gay-Lussac
Tekanan tetap → V/T = Konstan → V1/T1 = V2/T2
Hukum Charles
Volume tetap → P/T = Konstan → P1/T1 = P2/T2
Hukum Boyle
Suhu tetap → PV = Konstan → P1V1 = P2V2
P, V, T Berubah (non adiabatis)
(P1V1) / (T1) = (P2V2) / (T2)
Adiabatis
P1V1 γ= P2V2γ
T1V1 γ − 1= T2V2γ − 1
γ = perbandingan kalor jenis gas pada tekanan tetap dan volum tetap → γ = Cp/Cv
Usaha
W = P(ΔV) → Isobaris
W = 0 → Isokhoris
W = nRT ln (V2 / V1) → Isotermis
W = − 3/2 nRΔT → Adiabatis ( gas monoatomik)
Keterangan :
T = suhu (Kelvin, jangan Celcius)
P = tekanan (Pa = N/m2)
V = volume (m3)
n = jumlah mol
1 liter = 10−3m3
1 atm = 105 Pa ( atau ikut soal!)
Jika tidak diketahui di soal ambil nilai ln 2 = 0,693
Mesin Carnot
η = ( 1 − Tr / Tt ) x 100 %
η = ( W / Q1 ) x 100%
W = Q1 − Q2
Keterangan :
η = efisiensi mesin Carnot (%)
Tr = suhu reservoir rendah (Kelvin)
Tt = suhu reservoir tinggi (Kelvin)
W = usaha (joule)
Q1 = kalor masuk / diserap reservoir tinggi (joule)
Q2 = kalor keluar / dibuang reservoir rendah (joule)
Rumus Dasar Termodinamika
14.38 |
Read User's Comments(0)
TERMODINAMIKA
14.34 |
Termodinamika
Termodinamika (bahasa Yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisika energi , panas, kerja, entropi dan kespontanan proses. Termodinamika berhubungan dekat dengan mekanika statistik di mana banyak hubungan termodinamika berasal.
Pada sistem di mana terjadi proses perubahan wujud atau pertukaran energi, termodinamika klasik tidak berhubungan dengan kinetika reaksi
(kecepatan suatu proses reaksi berlangsung). Karena alasan ini,
penggunaan istilah "termodinamika" biasanya merujuk pada termodinamika
setimbang. Dengan hubungan ini, konsep utama dalam termodinamika adalah proses kuasistatik, yang diidealkan, proses "super pelan". Proses termodinamika bergantung-waktu dipelajari dalam termodinamika tak-setimbang.
Karena termodinamika tidak berhubungan dengan konsep waktu, telah diusulkan bahwa termodinamika setimbang seharusnya dinamakan termostatik.
Hukum
termodinamika kebenarannya sangat umum, dan hukum-hukum ini tidak
bergantung kepada rincian dari interaksi atau sistem yang diteliti. Ini
berarti mereka dapat diterapkan ke sistem di mana seseorang tidak tahu
apa pun kecual perimbangan transfer energi dan wujud di antara mereka
dan lingkungan. Contohnya termasuk perkiraan Einstein tentang emisi spontan dalam abad ke-20 dan riset sekarang ini tentang termodinamika benda hitam.
Konsep dasar dalam termodinamika
Pengabstrakan
dasar atas termodinamika adalah pembagian dunia menjadi sistem dibatasi
oleh kenyataan atau ideal dari batasan. Sistem yang tidak termasuk
dalam pertimbangan digolongkan sebagai lingkungan. Dan pembagian sistem
menjadi subsistem masih mungkin terjadi, atau membentuk beberapa sistem
menjadi sistem yang lebih besar. Biasanya sistem dapat diberikan keadaan
yang dirinci dengan jelas yang dapat diuraikan menjadi beberapa
parameter !
Sistem termodinamika
Sistem termodinamika adalah bagian dari jagat raya
yang diperhitungkan. Sebuah batasan yang nyata atau imajinasi
memisahkan sistem dengan jagat raya, yang disebut lingkungan.
Klasifikasi sistem termodinamika berdasarkan pada sifat batas
sistem-lingkungan dan perpindahan materi, kalor dan entropi antara
sistem dan lingkungan.
Ada tiga jenis sistem berdasarkan jenis pertukaran yang terjadi antara sistem dan lingkungan:
- sistem terisolasi: tak terjadi pertukaran panas, benda atau kerja dengan lingkungan. Contoh dari sistem terisolasi adalah wadah terisolasi, seperti tabung gas terisolasi.
- sistem tertutup: terjadi pertukaran energi (panas dan kerja) tetapi tidak terjadi pertukaran benda dengan lingkungan. Rumah hijau adalah contoh dari sistem tertutup di mana terjadi pertukaran panas tetapi tidak terjadi pertukaran kerja dengan lingkungan. Apakah suatu sistem terjadi pertukaran panas, kerja atau keduanya biasanya dipertimbangkan sebagai sifat pembatasnya:
- pembatas adiabatik: tidak memperbolehkan pertukaran panas.
- pembatas rigid: tidak memperbolehkan pertukaran kerja.
- sistem terbuka: terjadi pertukaran energi (panas dan kerja) dan benda dengan lingkungannya. Sebuah pembatas memperbolehkan pertukaran benda disebut permeabel. Samudra merupakan contoh dari sistem terbuka.
Dalam kenyataan, sebuah sistem tidak
dapat terisolasi sepenuhnya dari lingkungan, karena pasti ada terjadi
sedikit pencampuran, meskipun hanya penerimaan sedikit penarikan gravitasi. Dalam analisis sistem terisolasi, energi yang masuk ke sistem sama dengan energi yang keluar dari sistem.
Keadaan termodinamika
Ketika sistem dalam keadaan seimbang dalam kondisi yang ditentukan, ini disebut dalam keadaan pasti (atau keadaan sistem).
Untuk
keadaan termodinamika tertentu, banyak sifat dari sistem
dispesifikasikan. Properti yang tidak tergantung dengan jalur di mana
sistem itu membentuk keadaan tersebut, disebut fungsi keadaan dari
sistem. Bagian selanjutnya dalam seksi ini hanya mempertimbangkan
properti, yang merupakan fungsi keadaan.
Jumlah properti minimal yang harus dispesifikasikan untuk menjelaskan keadaan dari sistem tertentu ditentukan oleh Hukum fase Gibbs. Biasanya seseorang berhadapan dengan properti sistem yang lebih besar, dari jumlah minimal tersebut.
Pengembangan hubungan antara properti dari keadaan yang berlainan dimungkinkan. Persamaan keadaan adalah contoh dari hubungan tersebut.
Hukum-hukum Dasar Termodinamika
Terdapat empat Hukum Dasar yang berlaku di dalam sistem termodinamika, yaitu:
- Hukum Awal (Zeroth Law) Termodinamika
Hukum
ini menyatakan bahwa dua sistem dalam keadaan setimbang dengan sistem
ketiga, maka ketiganya dalam saling setimbang satu dengan lainnya.
- Hukum Pertama Termodinamika
Hukum ini terkait dengan kekekalan energi. Hukum ini menyatakan perubahan energi dalam dari suatu sistem termodinamika tertutup sama dengan total dari jumlah energi kalor yang disuplai ke dalam sistem dan kerja yang dilakukan terhadap sistem.
- Hukum kedua Termodinamika
Hukum
kedua termodinamika terkait dengan entropi. Hukum ini menyatakan bahwa
total entropi dari suatu sistem termodinamika terisolasi cenderung untuk
meningkat seiring dengan meningkatnya waktu, mendekati nilai
maksimumnya.
- Hukum ketiga Termodinamika
Hukum ketiga termodinamika terkait dengan temperatur nol absolut.
Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur
nol absolut, semua proses akan berhenti dan entropi sistem akan
mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda
berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Aplikasi Termodinamika Di Kehidupan Sehari-hari
13.43 |
Aplikasi Termodinamika dalam
Kehidupan Sehari-hari
Hukum
termodinamika telah berhasil diterapkan dalam penelitian tentang proses kimia
dan fisika. Hukum pertama termodinamika didasarkan pada hukum kekekalan energi.
Hukum kedua termodinamika berkenaan dengan proses alami atau proses spontan
dimana fungsi yang memprediksi kespontanan reaksi ialah entropi, yang merupakan
ukuran ketidakteraturan suatu sistem. Hukum kedua ini menyatakan bahwa untuk
proses spontan, perubahan entropi semesta haruslah positif. Sedangkan hukum
ketiga termodinamika memungkinkan untuk menentukan nilai entropi mutlak (Chang,
2002: 165).
Berikut
beberapa contoh aplikasi termodinamika yang biasa digunakan dalam kehidupan
sehari-hari :
1.
Air Conditioner (AC)
Sistem
kerja AC terdiri dari bagian yang berfungsi untuk menaikkan dan menurunkan
tekanan supaya penguapan dan penyerapan panas dapat berlangsung.
Kompresor
yang ada pada sistem pendingin dipergunakan sebagai alat untuk memampatkan
fluida kerja (refrigent), jadi refrigent yang masuk ke dalam kompresor
dialirkan ke kondenser yang kemudian dimampatkan di kondenser.
Di bagian kondenser ini refrigent
yang dimampatkan akan berubah fase dari refrigent fase uap menjadi refrigent
fase cair, maka refrigent mengeluarkan kalor yaitu kalor penguapan yang
terkandung di dalam refrigent. Adapun besarnya kalor yang dilepaskan oleh
kondenser adalah jumlahan dari energi kompresor yang diperlukan dan energi
kalor yang diambil evaparator dari substansi yang akan didinginkan.
Pada kondensor, tekanan refrigent
yang berada dalam pipa-pipa kondensor relatif jauh lebih tinggi dibandingkan
dengan tekanan refrigent yang berada pada pipi-pipa evaporator.
Setelah
refrigent lewat kondensor dan melepaskan kalor penguapan dari fase uap ke fase
cair maka refrigent dilewatkan melalui katup ekspansi, pada katup ekspansi ini
refrigent tekanannya diturunkan sehingga refrigent berubah kondisi dari fase
cair ke fase uap yang kemudian dialirkan ke evaporator, di dalam evaporator ini
refrigent akan berubah keadaannya dari fase cair ke fase uap, perubahan fase
ini disebabkan karena tekanan refrigent dibuat sedemikian rupa sehingga
refrigent setelah melewati katup ekspansi dan melalui evaporator tekanannya
menjadi sangat turun.
Hal
ini secara praktis dapat dilakukan dengan jalan diameter pipa yang ada
dievaporator relatif lebih besar jika dibandingkan dengan diameter pipa yang
ada pada kondenser.
Dengan
adanya perubahan kondisi refrigent dari fase cair ke fase uap maka untuk
merubahnya dari fase cair ke refrigent fase uap maka proses ini membutuhkan
energi yaitu energi penguapan, dalam hal ini energi yang dipergunakan adalah
energi yang berada didalam substansi yang akan didinginkan.
Dengan diambilnya energi yang diambil dalam substansi yang akan
didinginkan maka entalpi, substansi yang akan didinginkan akan menjadi
turun, dengan turunnya entalpi maka temperatur dari substansi yang akan
didinginkan akan menjadi turun. Proses ini akan berubah terus-menerus sampai
terjadi pendinginan yang sesuai dengan keinginan.
Berikut rangkaian gambar skema kerja dari AC :
2.
Dispenser
Prinsip kerja pemanas air
Proses pemanasan air terjadi pada
saat air masuk kedalam tabung pemanas. Tabung pemanas merupakan tabung yang
terbuat dari logam yang disekitar tabung tersebut dikelilingi oleh elemen
pemanas, sehingga ketika air mengalir dari tampungan menuju tabung pemanas
sensor suhu yang ada pada tabung pemanas akan memicu elemen pemanas untuk
bekerja, suhu tinggi yang dihasilkan elemen pemanas diserap oleh air yang
suhunya lebih rendah, setelah suhu air dalam tabung pemanas tinggi maksimal
sensor suhu yang ada pada tabung pemanas akan memutuskan arus listrik pada
elemen pemanas, pada saat elemen pemanas menyala lampu indikator pemanas
menyala dan pada saat elemen pemanas mati lampu indikator pemanas mati.
Pada tabung dispenser dipasang
Heater/pemanas serta sensor suhu atau thermostat yang berfungsi untuk membatasi
kerja heater agar tidak bekerja terus-menerus yang akan menimbulkan suhu air
dalam tabung dispenser berlebihan, karena apabila heater berkerja berlebih,
heater akan panas dan bahkan heater tersebut akan terjadi kerusakan didalamnya.
Untuk mengurangi terjadinya resiko tersebut, di heater dipasang thermostat yang
berguna untuk mengatur suhu.
Ketika suhu air yang dipanaskan
oleh heater mencapai suhu tertentu sehingga melebihi suhu kerja
sensor/thermostat maka sensor akan bekerja dan memutuskan arus yang mengalir ke
heater, dengan demikian heater akan berhenti bekerja sehingga suhu air tetap
terjaga sesuai dengan kebutuhan, bisa dilihat di lampu indikator dari warna
merah akan berganti warna hijau. Heater akan bekerja kembali manakala suhu
air pada tabung menurun sampai suhunya berada dibawah suhu kerja sensor, sensor
dipasang seri dengan heater, dengan demikian fungsi dari sensor ini mirip
seperti saklar, hanya saja bekerjanya secara otomatis berdasarkan perubahan
suhu.
Prinsip kerja pendingin air
Proses
pendinginan air pada dispenser pada umumnya dibedakan menjadi 2 yaitu:
1. Pendinginan Air
dengan Fan
Proses pendinginan air menggunakan
fan dilakukan dengan cara menghisap suhu tinggi pada air ketika air berada pada
tampungan air kedua yang letaknya berada dibawah tampungan air pertama, namun
pada kenyataannya fan hanya alat bantu untuk mempercepat pembuangan panas pada
air, sehingga temperatur air hanya akan turun sedikit saja. Setelah melewati
tampungan air kedua air akan dikeluarkan melalui keran dan siap untuk diminum.
2. Pendinginan Air
dengan Sistem Refrigran
Pendinginan air pada dispenser
menggunakan sistem refrigran sama seperti sistem refrigran pada kulkas hanya
saja evaporatornya dimasukkan kedalam tampungan air kedua yang berada dibawah
tampungan air pertama, sehingga air disekitar evapurator akan menjadi air
dingin. Hasil pendinginan air pada dispenser menggunakan sistem refrigran lebih
maksimal dibandingkan pendinginan air menggunakan fan. Setelah air melalui
proses pendinginan pada tampungan air kedua, air akan mengalir dan keluar
memalui keran.
Nama komponen pada dispenser:
1. Saklar
On/Off
2. Thermostat
1
3. Thermostat
2
4. Saluran
daya utama
5. Elemen
pemanas
6. Saluran
air panas
7. Saluran
air normal
3. Rice Cooker
Pada
rice cooker, energi panas ini
dihasilkan dari energi listrik. Suatu cairan akan menguap bila tekanan uap gas
yang berasal dari cairan adalah sama dengan tekanan dari cairan ke sekitarnya
(Puap = Pcair). Jadi, titik didih suatu cairan sebenarnya bisa dimanipulasi
dengan meningkatkan tekanan di luar cairan (tekanan eksternal). Pada penanak
nasi biasa, air akan dididihkan dengan tekanan eksternal biasa, yaitu 101 kPa,
dan mendidih pada titik didih biasa, yaitu 100°C (373 K).
Sementara, pada penanak nasi yang
memanipulasi tekanan (pressure cooker, atau electric pressure cooker)
jika tutup lubang uapnya dibuka, maka pressure cooker akan bekerja
seperti penanak nasi biasa, karena tekanan eksternalnya sama dengan tekanan
udara luar.
Namun, jika tutup lubang uapnya
(biasanya berupa katup) ditutup, akan ada perubahan pada tekanan udara di ruang
dalam pressure cooker dan titik didih cairan akan berubah. Ketika katupnya
ditutup, kondisi sistem berubah karena uap airnya hanya dapat berada di dalam
ruang pressure cooker.
Karena ada
tambahan massa (tutup katup), tekanan makin tinggi dan titik kesetimbangan
antar fase (dalam hal ini, antara fase cair dan fase uap) berubah ke temperatur
yang lebih tinggi, dan terbentuklah titik didih baru.
Massa tutup katup menentukan tekanan
di dalam ruang pressure cooker, karena lubang katup akan membiarkan uap
air keluar ketika tekanannya telah mencapai titik tertentu. Kelebihan tekanan
akan dikurangi dengan melepaskan sedikit uap melalui katup.
Apa itu termodinamika?
20.11 |
PENGERTIAN TERMODINAMIKA
Termodinamika bersal dari (bahasa yunani: thermos = 'panas' and dynamic = 'perubahan') adalah fisiska energi , panas, kerja,entropi dan kespontanan proses.
Hukum termodinamika kebenarannya sangat umum, dan hukum-hukum ini
tidak bergantung kepada rincian dari interaksi atau sistem yang
diteliti. Ini berarti mereka dapat diterapkan ke sistem di mana
seseorang tidak tahu apa pun kecuali perimbangan transfer energi dan
wujud di antara mereka dan lingkungan.
Termodinamika adalah satu cabang fisika teoritik yang berkaitan
dengan hukum-hukum pergerakan
panas,dan perubahan dari panas menjadi bentuk-bentuk energi
yang lain.Istilah ini diturunkan dari bahasa yunani Therme (panas) dan dynamis (gaya).Cabang ilmu ini berdasarkan pada dua prinsip dasar yang
aslinya diturunkan dari eksperimen,tapi kini dianggap
sebagai aksiom.prinsip pertama adalah hukum kekekalan
energi,yang mengambil bentuk hukum kesetaraan panas dan
kerja.Prinsip yang kedua menyatakan bahwa panas itu sendiri tidak dapat mengalir dari benda yang lebih dingin ke benda yang lebih panas tanpa
adanya perubahan dikedua benda tersebut.
HUKUM I TERMODINAMIKA
Contoh:
Pecahan gelas dan percikan air memiliki tingkat entropi lebih tinggi dibandingkan dengan gelas yang menyatu dan terisi di atas meja. Contoh lain telur yang digoreng memiliki tingkat entropi yang tinggi.
Ketika suatu sistem menyerap sejumlah kalor Q dari reservoir yang memiliki temperatur mutlak, entropi sistem tersebut akan meningkat dan entropi reservoirnya akan menurun sehingga perubahan entropi sistem dapat dinyatakan dengan persamaan
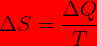
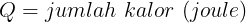
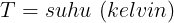
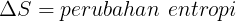
Ciri proses reversible adalah perbuhan total entropi (ΔS = 0 )baik bagi sistem maupun lingkungan. Pada irreversible perubahan entropi ΔS > 0 . Proses irreversible selalu menaikan entropi semesta
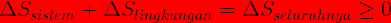

Gambar di samping menunjukkan bahwa 1.200 J kalor mengalir secara spontan dari reservoir panas bersuhu
600 K ke reservoir dingin bersuhu 300 K. Tentukanlah jumlah entropi dari sistem tersebut. Anggap tidak ada
perubahan lain yang terjadi.
Diketahui:
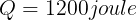
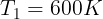
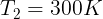
Perubahan pada reservoir panas (yang memberikan kalor diberi tanda "-")
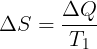
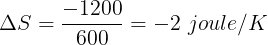
Perubahan pada reservoir dingin (positif karena menerima kalor)
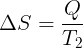
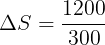
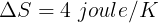
Total perubahan entropi adalah jumlah aljabar perubahan entropi setiap reservoir
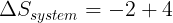
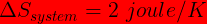
Perubahan entropi reservoir adalah

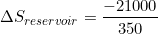
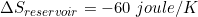
(tanda " - " menunjukkan kalor dilepas )
Perubahan entropi keseluruhan sistem adalah


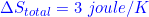
Hukum I Termodinamika berkaitan dengan Hukum Kekekalan Energi untuk
sebuah sistem yang sedang melakukan pertukaran energi dengan lingkungan
dan memberikan hubungan antara kalor, energi, dan usaha.
Hukum I
Termodinamika menyatakan bahwa“ untuk setiap proses, apabila kalor
ditambahkan ke dalamsistem dan sistem melakukan usaha, maka akan
terjadiperubahan energi” Jadi, dapat dikatakan bahwa Hukum I
Termodinamika menyatakan adanya konsep kekekalan energi.
Secara matematis, Hukum Pertama Termodinamika dituliskan sebagai
berikut.dengan:
Q = kalor yang diterima atau dilepaskan olehsistem
(Joule)
ΔU = U2 —U1=perubahan energi dalam sistem
W = usaha yang
dilakukan sistem (Newton)
Perjanjian tanda yang berlaku untuk persamaan
1.1tersebut adalah sebagai berikut :Jika sistem melakukan kerja maka
nilai W berharga positif.Jika sistem menerima kerja maka nilai W
berharga negatif Jika sistem melepas kalor maka nilai Q berharga
negatif Jika sistem menerima kalor maka nilai Q berharga positif
Perubahan yang terjadi pada gas berada dalam keadaan tekanan tetap.Usaha
yang dilakukan gas dalam proses ini memenuhi persamaan W = P ΔV = p(V2 –
V1). Dengan demikian, persamaan Hukum Pertama Termodinamika untuk
proses isobarik dapat dituliskan sebagai berikut.
Q = ΔU + W… 1.2
Suatu proses yang terjadi dalam sistem pada suhutetap. Besar usaha yang
dilakukan sistem proses isotermal ini adalah Oleh karena ΔT = 0, menurut
Teori Kinetik Gas, energi dalam sistem juga tidak berubah (ΔU = 0)
karena perubahan energi dalam bergantung pada perubahan suhu.Ingatlah
kembali persamaan energi dalam gas monoatomik yang dinyatakan dalam
persamaan
HUKUM KE II TERMODINAMIKA
HUKUM KE II TERMODINAMIKA
Hukum termodinamika II dalam pernyataan aliran kalor
"Kalor mengalir secara spontan dari suatu benda bersuhu tingg ke benda bersuhu rendah secara spontan dan tidak mengalir secara spontan dalam arah kebalikannya"
Hukum ke II Termodinamika dalam pernyataan tentang mesin kalor
"Tidak mungkin membuat suatu mesin kalor yang bekerja dalam satu siklus yang semata-mata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar"
Hukum II Termodinamika dalam pernyataan entropi
"Total entropi semesta tidak berubah ketika proses reversible terjadi dan bertambah ketika proses ireversible terjadi"Entropi
Entropi (S) adalah ukuran keacakan atau selang ketidakteraturan dalam suatu sistem. Entropi sistem meningkat ketika suatu keadaan yang teratur, tersusun dan terencana menjadi lebih tidak teratur, tersebar dan tidak terencana. Semakin tidak teratur, semakin tinggi pula entropinya. Dalam istilah yang lebih sederhana, entropi suatu sistem adalah suatu sistem dari manifestasi ketidakberaturan. Dengan kata lain entropi adalah banyaknya kalor atau energi yang tidak dapat diubah menjadi usahaContoh:
Pecahan gelas dan percikan air memiliki tingkat entropi lebih tinggi dibandingkan dengan gelas yang menyatu dan terisi di atas meja. Contoh lain telur yang digoreng memiliki tingkat entropi yang tinggi.
Ketika suatu sistem menyerap sejumlah kalor Q dari reservoir yang memiliki temperatur mutlak, entropi sistem tersebut akan meningkat dan entropi reservoirnya akan menurun sehingga perubahan entropi sistem dapat dinyatakan dengan persamaan
Ciri proses reversible adalah perbuhan total entropi (ΔS = 0 )baik bagi sistem maupun lingkungan. Pada irreversible perubahan entropi ΔS > 0 . Proses irreversible selalu menaikan entropi semesta
Contoh Soal
Gambar di samping menunjukkan bahwa 1.200 J kalor mengalir secara spontan dari reservoir panas bersuhu
600 K ke reservoir dingin bersuhu 300 K. Tentukanlah jumlah entropi dari sistem tersebut. Anggap tidak ada
perubahan lain yang terjadi.
Diketahui:
Perubahan pada reservoir panas (yang memberikan kalor diberi tanda "-")
Perubahan pada reservoir dingin (positif karena menerima kalor)
Total perubahan entropi adalah jumlah aljabar perubahan entropi setiap reservoir
Perubahan entropi reservoir adalah
(tanda " - " menunjukkan kalor dilepas )
Perubahan entropi keseluruhan sistem adalah
Langganan:
Postingan (Atom)






